
Conţinut
- TL; DR (Prea lung; nu a citit)
- Cum se calculează alunițele
- Convertirea în Mmol
- Concentrația soluției
- Exemplu
Pentru a le calcula pur și simplu, chimiștii au creat o unitate standard pentru numărul de atomi ai unui compus anume implicat într-o reacție sau un alt proces chimic. Acestea definesc un mol (mol) drept cantitatea de orice substanță care are același număr de unități fundamentale ca 12 grame de carbon-12, care este numărul Avogadros (6.022 × 1023). Sistemul de măsurare SI (metric) definește o milimolă (Mol) ca o milime dintr-o aluniță. În general, calculați numărul de alunițe ale unei substanțe cântărind cantitatea pe care o aveți la îndemână. Dacă doriți să convertiți la Mmol, înmulțiți cu 103 (1,000).
TL; DR (Prea lung; nu a citit)
Un aluniță este egal cu numărul de particule Avogadros dintr-un anumit compus. Un milimol (Mol) este o milime dintr-o aluniță.
Cum se calculează alunițele
Masele atomice sunt măsurate în unități de masă atomică (AMU). O AMU reprezintă exact 1/12 masa nucleului unui atom de carbon-12 în starea sa de sol. Un mol de substanță este definit ca fiind egal cu numărul de particule Avogadros din această substanță. Conform acestei definiții, greutatea unui mol a unei substanțe în grame este același număr ca și greutatea unei particule individuale a acestei substanțe în AMU. De exemplu, greutatea atomică a carbonului-12 este de 12 AMU, deci un mol de carbon-12 cântărește 12 grame.
Luați în considerare un recipient plin cu gaz de hidrogen (H2). Fiecare particulă din recipient este o moleculă formată din doi atomi de hidrogen, deci trebuie să știți doar masa atomică a hidrogenului pentru a calcula greutatea moleculară. Cele mai multe versiuni ale tabelului periodic prezintă masa atomică a fiecărui element sub simbolul său. Pentru hidrogen, care are un singur proton în nucleul său, 1.008 AMU, care este o medie a tuturor izotopilor de hidrogen care apar în mod natural. În consecință, masa atomică a gazului de hidrogen este 2,016 AMU, iar un mol de hidrogen gaz cântărește 2,016 grame. Pentru a găsi numărul de alunițe din eșantionul dvs., cântăriți proba în grame și împărțiți această greutate în greutate moleculară a hidrogenului gazos în grame. De exemplu, o probă care cântărește 15 grame de hidrogen pur conține 7,44 moli.
Convertirea în Mmol
Uneori, cantitățile supuse investigației sunt atât de mici încât exprimarea lor în alunițe este greoaie. Introduceți milimetrul. Înmulțind numărul de alunițe cu o mie, puteți converti un număr foarte mic într-unul mai ușor de gestionat. Acest lucru este deosebit de convenabil atunci când tratăm unități de volum de ordinul mililitrelor.
1 mol = 1.000 Mmol
Concentrația soluției
Chimiștii folosesc molaritatea ca măsură a concentrației unui anumit compus în soluție. Ele definesc molaritatea ca fiind numărul de alunițe pe litru. Convertiți molaritatea în milimolaritate înmulțind cu 1.000. De exemplu, o soluție de 1 mol (molar, scrisă și sub formă de M) are o concentrație de 1 mol pe litru. Aceasta este echivalentă cu o soluție de 1.000 Mmol (milimolară, scrisă uneori și sub formă de mM), care este una care conține 1.000 Mmol pe litru.
Exemplu
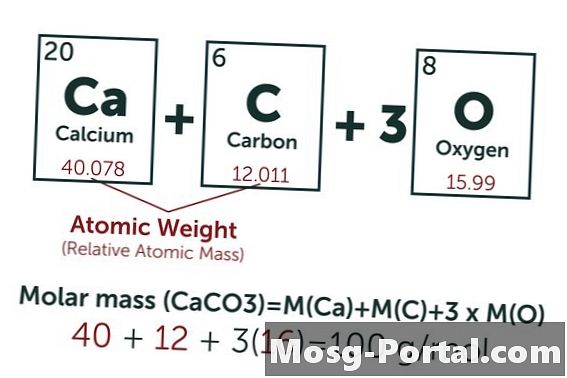
O soluție conține 0,15 grame de carbonat de calciu. Câte milimetri este asta?
Formula chimică a carbonatului de calciu este CaCO3. Greutatea atomică a carbonului (C) este de aproximativ 12 AMU, cea a oxigenului (O) aproximativ 16 AMU și cea a calciului (Ca) aproximativ 40 AMU. Fiecare moleculă de carbonat de calciu cântărește astfel 100 AMU, ceea ce înseamnă că o aluniță cântărește aproximativ 100 de grame. O greutate de 0,15 grame reprezintă 0,15 g ÷ 100 g / mol = 0,0015 moli. Aceasta este echivalentă cu 1,5 Mmol.
Care este molaritatea și milimolaritatea acestui carbonat de calciu mult în 2,5 litri de soluție?
Molaritatea este definită ca numărul de alunițe pe litru, deci împărțiți numărul de aluniți cu 2,5 pentru a obține molaritatea: 0,0015 ÷ 2,5 =
0,0006 M
Înmulțiți cu 1.000 pentru a obține milimolaritatea =
0,6 mM
Rețineți că ajungeți la același rezultat pentru milimolaritate dacă împărțiți numărul de milimetri la volumul soluției.