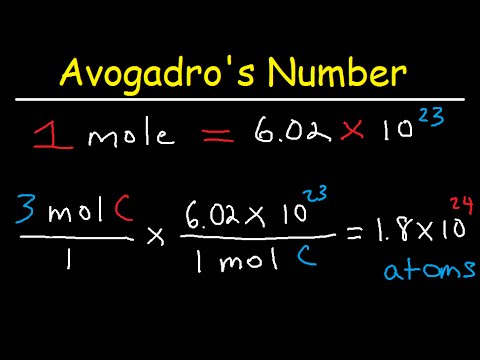
Alunița este unul dintre conceptele mai importante în chimie. În termeni tehnici, o aluniță este formată din 6.022 x 1023 molecule ale unei substanțe. În termeni mai practici, o aluniță este numărul de molecule necesare pentru a avea o cantitate de substanță în grame egală cu greutatea moleculară a substanței în unități de masă atomică sau amu. Prin urmare, dacă greutatea moleculară a unei substanțe reprezintă numărul de grame necesar pentru 1 mol, atunci numărul aluniților reprezentat de orice cantitate dată de substanță va fi egal cu gramele acelei substanțe împărțite la greutatea sa moleculară. Din punct de vedere matematic, aceasta este reprezentată de alunițe = grame ÷ greutate moleculară sau alunițe = g ÷ MW.
Determinați formula moleculară a compusului ale cărui alunițe vor fi calculate. Dacă aceste informații nu sunt deja disponibile, numeroase cărți de referință și baze de date online oferă aceste informații, inclusiv site-ul Institutului Național de Standarde și Tehnologie furnizează în secțiunea Resurse. Ca exemplu, să presupunem că ați dorit să determinați alunițele de aspirină într-o tabletă de aspirină de 250 mg. Introducerea „aspirinei” în baza de date NIST relevă faptul că numele chimic al medicamentului este acidul 2-acetiloxi-benzoic și formula moleculară a acestuia este C9H8O4. Acest lucru indică faptul că o moleculă de aspirină conține nouă atomi de carbon, opt atomi de hidrogen și patru atomi de oxigen.
Calculați greutatea moleculară a compusului utilizând greutățile atomice furnizate în tabelul periodic al elementelor. Înmulțiți numărul fiecărui tip de atom cu greutatea sa moleculară și apoi sumați produsele. În cazul aspirinei, ponderile moleculare ale carbonului, hidrogenului și oxigenului sunt 12,01, 1,01 și respectiv 16,00 amu. Prin urmare, greutatea moleculară a aspirinei este 9 (12,01) + 8 (1,01) + 4 (16,00) = 180,17 amu.
Calculați moli de substanță împărțind masa substanței în grame la greutatea moleculară în amu. În acest caz, tableta de aspirină conține 250 mg, sau 0,250 g. Prin urmare, 0,250 g ÷ 180,17 amu = 0,00139 moli de aspirină.