Conţinut
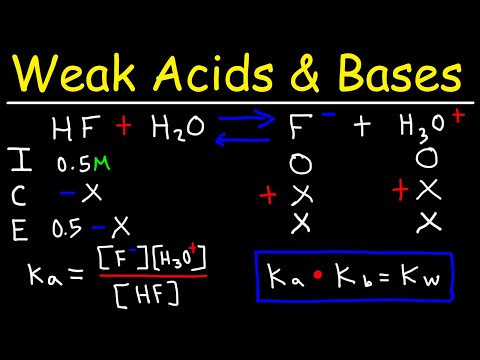
Definiția Bronsted Lowry a unui acid și a unei baze este aceea că un acid donează ioni de hidrogen, în timp ce o bază primește ioni de hidrogen. Kb este constanta de disociere a bazei sau modul în care ionii care compun baza se separă în componentele lor pozitive și negative. Ka este constanta de disociere a acidului. Cu cât valoarea Kb este mai mare, cu atât baza este mai puternică și mai mare valoarea Ka, cu atât acidul este mai puternic. Înmulțind Ka cu Kb, primiți Kw, sau constanta de disociere pentru apă, care este 1,0 x 10 ^ -14. Când găsiți Kb din Ka, este necesar să conectați aceste diferite părți ale ecuației.
Citiți problema și scrieți informațiile oferite. Într-o problemă care implică calcularea Kb din Ka, vi se oferă de obicei Ka și Kw. De exemplu, vi se poate cere să calculați Kb al ionului de clorură. Ka dat de acidul conjugat al ionului de clorură, care este clorură de hidrogen, este 1,0 x 10 ^ 6. Kw-ul dat este 1,0 x 10 ^ -14.
Scrieți ecuația pentru Ka, Kb și Kw, care este Kw = (Ka) (Kb). Rezolvați ecuația pentru Kb împărțind Kw-ul la Ka. Apoi obțineți ecuația Kb = Kw / Ka.
Introduceți valorile din problemă în ecuație. De exemplu, pentru ionul de clorură, Kb = 1,0 x 10 ^ -14 / 1,0 x 10 ^ 6. Kb este 1.0x10 ^ -20.