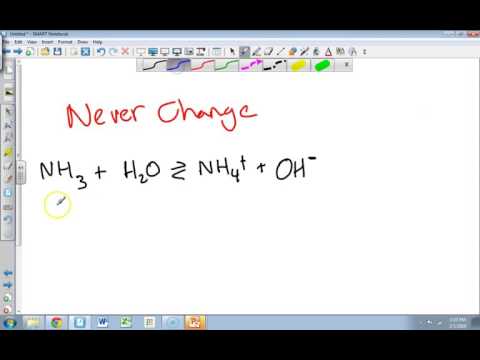
Amoniacul (NH3) este un gaz care se dizolvă ușor în apă și se comportă ca bază. Echilibrul de amoniac este descris cu ecuația NH3 + H2O = NH4 (+) + OH (-). Formal, aciditatea soluției este exprimată sub formă de pH. Acesta este logaritmul concentrației ionilor de hidrogen (protoni, H +) din soluție. Constanta de disociere a bazei (Kb) este definită ca Kb = /. (Parantezele se referă la concentrația molară de ioni sau molecule din soluție.) Kb este o constantă la o temperatură dată și este de obicei tabulată la 25 de grade Celsius. Valoarea Kb pentru amoniac este 1.8E-5 (notația „E-5” înseamnă „zece la putere -5”).
Înmulțiți valoarea Kb cu concentrația totală de amoniac și numărul 4. Concentrația totală este suma și în soluție. Această concentrație trebuie cunoscută sau dată pentru a calcula pH-ul. De exemplu, concentrația este egală cu 0,1 molar. Atunci valoarea acestui pas trebuie calculată ca 1.8E-5 x 0.1 x 4 = 7.2E-6.
Luăm rădăcina pătrată a valorii obținute la Pasul 1. În exemplu, este sqrt (7.2E-6) = 2.683E-3. (Rețineți că acest rezultat este rotunjit la mii.)
Scădeați valoarea Kb din numărul obținut în Etapa 2 și apoi împărțiți rezultatul cu 2 pentru a calcula concentrația ionilor de hidroxid (OH-). În exemplul nostru, = (2.683E-3 - 1.8E-5) / 2 = 1.333E-3 molar.
Împărțiți mărimea 1E-14 la concentrația ionilor de hidroxid (Etapa 3) pentru a calcula concentrația protonilor: = 1E-14 /. În exemplul nostru, = 1E-14 / 1.333E-3 = 7.502E-11.
Luați logaritmul (cu baza 10) a concentrației de protoni (Etapa 4) și multiplicați rezultatul cu -1 pentru a calcula pH-ul. În acest exemplu, pH = -1 x jurnal (7.502E-11) = 10.12.