Conţinut
- Elemente Paramagnetice vs. Diamagnetice
- Calcularea dacă un element este paramagnetic sau diamagnetic
- O listă de atomi paramagnetici
- Compuși paramagnetici
Toți atomii răspund într-un fel la câmpurile magnetice, dar aceștia răspund diferit în funcție de configurația atomilor care înconjoară nucleul. În funcție de această configurație, un element poate fi diamagnetic, paramagnetic sau ferromagnetic. Elementele care sunt diamagnetice - care sunt de fapt toate, într-o oarecare măsură - sunt slab respinse de un câmp magnetic, în timp ce elementele paramagnetice sunt slab atrase și pot deveni magnetizate. Materialele ferromagnetice au și capacitatea de a se magnetiza, dar spre deosebire de elementele paramagnetice, magnetizarea este permanentă. Atât paramagnetismul, cât și ferromagnetismul sunt mai puternice decât diamagnetismul, astfel încât elementele care prezintă fie paramagnetism, fie ferromagnetism nu mai sunt diamagnetice.
Doar câteva elemente sunt ferromagnetice la temperatura camerei. Acestea includ fierul (Fe), nichelul (Ni), cobaltul (Co), gadoliniu (Gd) și - așa cum au descoperit recent oamenii de știință - ruteniul (Ru). Puteți realiza un magnet permanent cu oricare dintre aceste metale, expunându-l la un câmp magnetic. Lista atomilor paramagnetici este mult mai lungă. Un element paramagnetic devine magnetic în prezența unui câmp magnetic, dar își pierde proprietățile magnetice imediat ce eliminați câmpul. Motivul acestui comportament este prezența unuia sau mai multor electroni neperecheți în carcasa orbitala exterioară.
Elemente Paramagnetice vs. Diamagnetice
Una dintre cele mai importante descoperiri în știință din ultimii 200 de ani este interconectarea electricității și a magnetismului. Deoarece fiecare atom are un nor de electroni încărcați negativ, acesta are potențial pentru proprietăți magnetice, dar indiferent dacă acesta afișează ferromagnetism, paramagnetism sau diamagnetism depinde de configurația lor. Pentru a aprecia acest lucru, este necesar să înțelegeți modul în care electronii decid ce orbite trebuie să ocupe în jurul nucleului.
Electronii au o calitate numită rotire, pe care o puteți vizualiza ca direcție de rotație, deși este mai complicat de atât. Electronii pot avea „spin-up” (pe care îl puteți vizualiza ca rotire în sensul acelor de ceasornic) sau „spin-down” (în sens invers acelor de ceasornic). Se aranjează la distanțe crescute, strict definite de nucleul numit cochilii, iar în interiorul fiecărei cochilii sunt subshells care au un număr discret de orbitale care pot fi ocupate de maximum doi electroni, fiecare având rotirea opusă. Se spune că doi electroni care ocupă un orbital sunt împerecheți. Rotirile lor se anulează și nu creează niciun moment magnetic net. Pe de altă parte, un singur electron care ocupă un orbital nu este împerecheat și rezultă un moment magnetic net.
Elementele diamagnetice sunt cele fără electroni neperecheți. Aceste elemente se opun slab unui câmp magnetic, pe care oamenii de știință îl demonstrează adesea levitând un material diamagnetic, cum ar fi grafitul pirolitic sau o broască (da, o broască!) Peste un electromagnet puternic. Elementele paramagnetice sunt cele care au electroni neperecheți. Acestea oferă atomului un moment dipol magnetic net, iar atunci când este aplicat un câmp, atomii se aliniază cu câmpul, iar elementul devine magnetic. Când eliminați câmpul, energia termică intervine pentru a randomiza alinierea, iar magnetismul se pierde.
Calcularea dacă un element este paramagnetic sau diamagnetic
Electronii umplu cochilii în jurul nucleului într-un mod care minimizează energia netă. Oamenii de știință au descoperit trei reguli pe care le urmează atunci când fac acest lucru, cunoscut sub numele de Principiul Aufbrau, Regula Sutelor și Principiul Excluderii Pauli. Aplicând aceste reguli, chimiștii pot determina câți electroni ocupă fiecare dintre subsectele care înconjoară un nucleu.
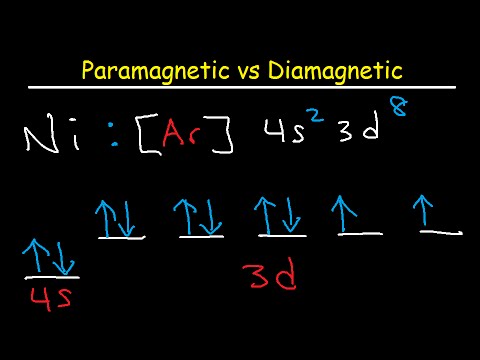
Pentru a determina dacă un element este diamagnetic sau paramagnetic, este necesar să ne uităm doar la electronii de valență, care sunt cei care ocupă subshellul cel mai exterior. Dacă subschellul cel mai exterior conține orbitale cu electroni neperecheți, elementul este paramagnetic. În caz contrar, diamagnetic. Oamenii de știință identifică subshells-urile ca s, p, d și f. La scrierea configurației electronilor, convenția trebuie să precede electronii de valență de gazul nobil care precede elementul în cauză în tabelul periodic. Gazele nobile au orbite electronice complet umplute, motiv pentru care sunt inerte.
De exemplu, configurația electronilor pentru magneziu (Mg) este 3s2. Subsulul cel mai exterior conține doi electroni, dar nu sunt împerecheați, deci magneziul este paramagnetic. Pe de altă parte, configurația electronilor de zinc (Zn) este de 4s23d10. Nu are electroni neperecuși în carcasa sa exterioară, astfel încât zincul este diamagnetic.
O listă de atomi paramagnetici
Puteți calcula proprietățile magnetice ale fiecărui element scriind configurațiile electronilor lor, dar, din fericire, nu trebuie. Chimiștii au creat deja un tabel cu elemente paramagnetice. Acestea sunt următoarele:
Compuși paramagnetici
Când atomii se combină pentru a forma compuși, unii dintre acești compuși pot, de asemenea, să prezinte paramagnetism din același motiv pentru care îl fac elementele. Dacă există unul sau mai mulți electroni neperecheți în orbitalii compuși, compusul va fi paramagnetic. Exemplele includ oxigenul molecular (O)2), oxid de fier (FeO) și oxid nitric (NO). În cazul oxigenului, este posibil să se afișeze acest paramagnetism folosind un electromagnet puternic. Dacă turnați oxigen lichid între poli ai unui astfel de magnet, oxigenul se va colecta în jurul polilor, deoarece se vaporizează pentru a crea un nor de gaz de oxigen. Încercați același experiment cu azot lichid (N2), ceea ce nu este paramagnetic și nu se va forma un astfel de nor.
Dacă doriți să compilați o listă de compuși paramagnetici, ar trebui să examinați configurațiile electronilor. Deoarece electronii neperecheți din cojile de valență exterioară care conferă calități paramagnetice, compușii cu astfel de electroni fac lista. Acest lucru nu este întotdeauna adevărat. În cazul moleculei de oxigen, există un număr egal de electroni de valență, dar fiecare ocupă o stare de energie mai mică pentru a minimiza starea energetică totală a moleculei. În loc de o pereche de electroni într-un orbital superior, există doi electroni neperecați în orbitalele inferioare, ceea ce face molecula paramagnetică.