Conţinut
- TL; DR (Prea lung; nu a citit)
- Configurații electronice
- Notare rapidă pentru configurare
- Diagrame orbitale
- Diagrame punct
Diagramele orbitale ale electronilor și configurațiile scrise vă spun ce orbitale sunt umplute și care sunt parțial umplute pentru orice atom. Numărul de electroni de valență are impact asupra proprietăților lor chimice, iar ordonarea specifică și proprietățile orbitalelor sunt importante în fizică, astfel încât mulți studenți trebuie să ajungă la cunoștință cu elementele de bază. Vestea bună este că diagramele orbitale, configurațiile electronilor (atât în forma scurtă, cât și în forma completă) și diagramele punctelor pentru electroni sunt cu adevărat ușor de înțeles odată ce ai înțeles câteva elemente de bază.
TL; DR (Prea lung; nu a citit)
Configurațiile electronice au formatul: 1s2 2s2 2p6 . Primul număr este numărul cuantic principal (n) și litera reprezintă valoarea lui l (număr cuantic momentan; 1 = s, 2 = p, 3 = d și 4 = f) pentru orbital, iar numărul superscript spune tu câți electroni sunt în acel orbital. Diagramele orbitale folosesc același format de bază, dar în loc de numere pentru electroni, acestea folosesc săgeți ↑ și ↓, precum și oferind fiecărui orbital propria linie, pentru a reprezenta și rotirile electronilor.
Configurații electronice
Configurațiile electronilor sunt exprimate printr-o notație care arată astfel: 1s2 2s2 2p1. Aflați cele trei părți principale ale acestei notații pentru a înțelege cum funcționează. Primul număr vă spune „nivelul de energie” sau numărul cuantic principal (n). A doua literă vă indică valoarea (l), numărul cuantic de moment unghiular. Pentru l = 1, litera este s, pentru l = 2 este p, pentru l = 3 este, pentru l = 4 este f și pentru numere mai mari crește alfabetic din acest punct.Amintiți-vă că s orbitalele conțin maxim doi electroni, p orbitali maxim șase, d maxim 10 și f maxim 14.
Principiul Aufbau vă spune că orbitele cu cea mai mică energie se completează mai întâi, dar ordinea specifică nu este secvențială într-un mod ușor de memorat. Consultați Resurse pentru o diagramă care arată comanda de completare. Rețineți că nivelul n = 1 are doar s orbitali, nivelul n = 2 are s și p orbitalele, iar nivelul n = 3 are numai s, p și d orbitali.
Aceste reguli sunt ușor de lucrat, astfel încât nota pentru configurarea scandiumului este:
1s2 2s2 2p6 3s2 3p6 4s2 3d1
Ceea ce arată că toate nivelurile n = 1 și n = 2 sunt pline, nivelul n = 4 a fost început, dar coaja 3d conține un singur electron, în timp ce are o ocupație maximă de 10. Acest electron este electronul de valență.
Identificați un element din notație prin simpla numărare a electronilor și găsirea elementului cu un număr atomic potrivit.
Notare rapidă pentru configurare
Scrierea fiecărui orbital pentru elemente mai grele este obositoare, astfel încât fizicienii folosesc adesea o notație scurtă. Aceasta funcționează folosind gazele nobile (în coloana din dreapta-dreapta a tabelului periodic) ca punct de plecare și adăugând orbitale finale asupra lor. Deci, scandiul are aceeași configurație ca argonul, cu excepția electronilor din două orbitale suplimentare. Prin urmare, forma scurtă este:
4s2 3d1
Deoarece configurația argonului este:
= 1s2 2s2 2p6 3s2 3p6
Puteți utiliza acest lucru cu orice elemente în afară de hidrogen și heliu.
Diagrame orbitale
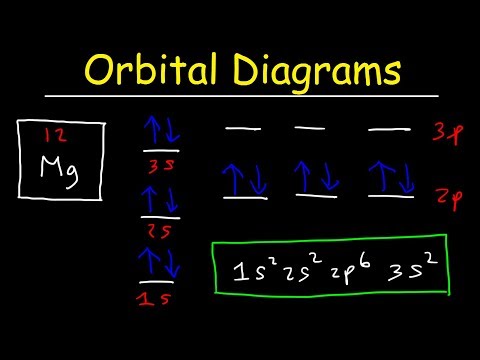
Diagramele orbitale sunt ca și nota de configurație tocmai introdusă, cu excepția rotirilor electronilor indicați. Folosiți principiul de excludere Pauli și regula lui Hund pentru a descoperi modul de completare a scoicilor. Principiul excluderii afirmă că niciun doi electroni nu pot împărtăși aceleași patru numere cuantice, ceea ce rezultă practic în perechi de stări care conțin electroni cu rotiri opuse. Regula lui Hund precizează că cea mai stabilă configurație este cea cu cel mai mare număr posibil de rotiri paralele. Acest lucru înseamnă că atunci când scrieți diagrame orbitale pentru cochilii parțial pline, completați toate electronii cu spin în sus înainte de a adăuga electroni cu spin în jos.
Acest exemplu arată modul în care funcționează diagramele orbitale, folosind argonul ca exemplu:
3p ↑ ↓ ↑ ↓ ↑ ↓
3s ↑ ↓
2p ↑ ↓ ↑ ↓ ↑ ↓
2s ↑ ↓
1s ↑ ↓
Electronii sunt reprezentați de săgeți, care indică, de asemenea, rotirile lor, iar nota din stânga este o notare de configurare electronică standard. Rețineți că orbitalii cu energie mai mare se află în partea de sus a diagramei. Pentru o coajă parțial plină, regula lui Hund necesită ca acestea să fie completate în acest fel (folosind ca exemplu azotul).
2p ↑ ↑ ↑
2s ↑ ↓
1s ↑ ↓
Diagrame punct
Diagrame punct sunt foarte diferite de diagramele orbitale, dar încă sunt foarte ușor de înțeles. Ele constau în simbolul elementului din centru, înconjurat de puncte care indică numărul de electroni de valență. De exemplu, carbonul are patru electroni de valență și simbolul C, deci este reprezentat ca:
∙
∙ C ∙
∙
Iar oxigenul (O) are șase, deci este reprezentat ca:
∙
∙∙ O ∙
∙∙
Când electronii sunt împărțiți între doi atomi (în legătură covalentă), atomii împart punctul în diagrama în același mod. Acest lucru face ca abordarea să fie foarte utilă pentru înțelegerea legăturilor chimice.