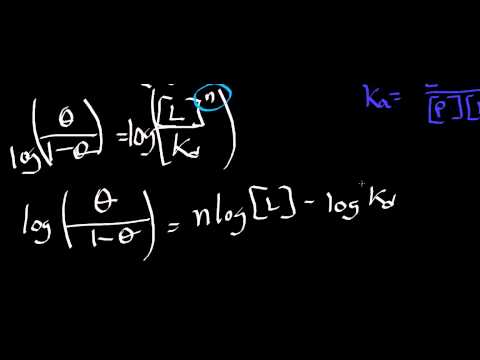
Conţinut
„Coeficientul de deal” sună ca un termen care se referă la abruptul unui grad. De fapt, este un termen în biochimie care se referă la comportamentul legării moleculelor, de obicei în sistemele vii. Este un număr fără unitate (adică nu are unități de măsură precum metri pe secundă sau grade pe gram) care se corelează cu cooperativity a legăturii dintre moleculele examinate. Valoarea sa este determinată empiric, ceea ce înseamnă că este estimată sau derivată dintr-un grafic de date conexe, în loc să fie utilizată în sine pentru a ajuta la generarea acestor date.
Altfel spus, coeficientul Hill este o măsură a măsurii în care comportamentul de legare între două molecule se abate de la hiperbolic relația așteptată în astfel de situații, în care viteza de legare și reacția ulterioară între o pereche de molecule (adesea o enzimă și substratul acesteia) crește inițial foarte repede cu creșterea concentrației de substrat înainte ca curba viteză-concentrație să se aplaneze și să se apropie de maxim teoretic fără să ajungem acolo. Graficul unei astfel de relații seamănă mai degrabă cu cadranul din stânga sus al unui cerc. Graficele curbelor viteză-concentrație pentru reacții cu coeficienți Hill ridicați sunt în schimb sigmoidal, sau în formă de s.
Aici sunt multe de despachetat în ceea ce privește baza coeficientului Hill și a termenilor înrudiți și cum să ne referim la determinarea valorii într-o situație dată.
Kinetica enzimelor
Enzimele sunt proteine care cresc ratele reacțiilor biochimice particulare cu cantități enorme, permițându-le să procedeze oriunde de la mii de ori mai rapid la mii de trilioane de ori mai rapid. Aceste proteine fac acest lucru scăzând energia de activare EA a reacțiilor exotermice. O reacție exotermică este aceea în care energia termică este eliberată și care, prin urmare, tinde să se desfășoare fără ajutor din afară. Deși produsele au o energie mai mică decât reactanții din aceste reacții, totuși, calea energetică de a ajunge acolo nu este de obicei o pantă descendentă constantă. În schimb, există o „cocotă de energie” pentru a trece, reprezentată de EA.
Imaginați-vă că conduceți din interiorul SUA, la aproximativ 1.000 de metri deasupra nivelului mării, spre Los Angeles, care se află pe Oceanul Pacific și clar la nivelul mării. Nu poți pur și simplu coasta de la Nebraska la California, deoarece între munți se află Munții Stâncoși, drumurile care traversează până la peste 5.000 de metri deasupra nivelului mării - iar în unele locuri, autostrăzile urcă până la 11.000 de metri deasupra nivelului mării. În acest cadru, gândiți-vă la o enzimă ca la ceva capabil să scadă mult înălțimea acelor vârfuri de munte din Colorado și să facă toată călătoria mai puțin dificilă.
Fiecare enzimă este specifică pentru un anumit reactant, numit a substrat în acest con. În acest fel, o enzimă este ca o cheie, iar substratul pentru care este specifică este ca blocajul pe care cheia este proiectat în mod unic pentru a se deschide. Relația dintre substraturi (S), enzime (E) și produse (P) poate fi reprezentată schematic prin:
E + S ⇌ ES → E + P
Săgeata bidirecțională din stânga indică faptul că, atunci când o enzimă se leagă de substratul său „atribuit”, poate să devină nelegată sau reacția să poată continua și să rezulte produs (e) plus enzima în forma sa originală (enzimele sunt modificate temporar doar în timp ce reacții de catalizare). Săgeata unidirecțională din dreapta, pe de altă parte, indică faptul că produsele acestor reacții nu se leagă niciodată de enzimă care a ajutat la crearea acestora odată ce complexul ES se va separa în părțile sale componente.
Cinetica enzimelor descrie cât de repede aceste reacții se finalizează (adică cât de rapid este generat produsul (ca funcție a concentrației enzimei și a substratului prezent, scris și. Biochimiștii au venit cu o varietate de grafice ale acestor date pentru a o face) cât se poate de semnificativ vizual.
Kinetica Michaelis-Menten
Majoritatea perechilor enzimă-substrat se supun unei ecuații simple numită formula Michaelis-Menten. În relația de mai sus, au loc trei reacții diferite: Combinarea E și S într-un complex ES, disocierea ES în componentele sale E și S și conversia ES în E și P. Fiecare dintre aceste trei reacții are constanta propriei viteze, care sunt k1, k-1 și k2, în această ordine.
Rata de apariție a produsului este proporțională cu constanta de viteză pentru acea reacție, k2și la concentrația complexului enzim-substrat prezent în orice moment,. Matematic, aceasta este scrisă:
dP / dt = k2
Partea din dreapta poate fi exprimată în termeni și. Derivarea nu este importantă în scopurile actuale, dar acest lucru permite calcularea ecuației de rată:
dP / dt = (k20) / (Km+)
În mod similar, viteza reacției V este dată de:
V = Vmax/ (Km+)
Constanta lui Michaelis Km reprezintă concentrația de substrat la care rata continuă la valoarea maximă teoretică.
Ecuația Lineweaver-Burk și complotul corespunzător este o modalitate alternativă de exprimare a acelorași informații și este convenabilă, deoarece graficul său este o linie dreaptă, mai degrabă decât o curbă exponențială sau logaritmică. Este reciproca ecuației Michaelis-Menten:
1 / V = (Km+) / Vmax = (Km/ Vmax) + (1 / Vmax )
Legare cooperativă
Unele reacții, în special, nu se supun ecuației Michaelis-Menten. Acest lucru se datorează faptului că legarea lor este influențată de factori de care ecuația nu ține cont.
Hemoglobina este proteina din globulele roșii care se leagă de oxigen (O2) în plămâni și îl transportă către țesuturile care necesită respirație. O proprietate remarcabilă a hemoglobinei A (HbA) este aceea că participă la legarea cooperativă cu O2. Aceasta înseamnă în esență că la O foarte mare2 concentrații, cum ar fi cele întâlnite la plămâni, HbA are o afinitate mult mai mare pentru oxigen decât o proteină de transport standard care se supune relației obișnuite de proteină hiperbolică-compus (mioglobina este un exemplu de o astfel de proteină). La O foarte scăzută2 concentrații, însă, HbA are o afinitate mult mai mică pentru O2 decât o proteină de transport standard. Acest lucru înseamnă că HbA o râvneste cu nerăbdare pe O2 unde este din belșug și la fel de nerăbdător să-l renunțe acolo unde este rar - exact ceea ce este necesar într-o proteină transportătoare de oxigen. Aceasta duce la curba de legare sigmoidal-vs.-presiune văzută cu HbA și O2, un beneficiu evolutiv fără de care viața ar merge cu siguranță într-un ritm substanțial mai puțin entuziast.
Ecuația de deal
În 1910, Archibald Hill a explorat cinematica O2-legarea hemoglobinei. El a propus ca Hb să aibă un număr specific de site-uri obligatorii, n:
P + nL ⇌ PLn
Aici, P reprezintă presiunea lui O2 iar L este scurt pentru ligand, ceea ce înseamnă orice lucru care ia parte la legare, dar în acest caz se referă la Hb. Rețineți că acest lucru este similar cu o parte din ecuația substrat-enzimă-produs de mai sus.
Constanta de disociere Kd pentru o reacție este scris:
n /
Întrucât fracția locurilor de legare ocupate binding, care variază de la 0 la 1,0, este dată de:
ϴ = n/ (Kd +n)
Unirea a toate acestea oferă una dintre numeroasele forme ale ecuației Hill:
log (ϴ /) = n log pO2 - jurnal P50
Unde P50 este presiunea la care jumătate din O2 site-urile de legare pe Hb sunt ocupate.
Coeficientul Hill
Forma ecuației Hill oferită mai sus este de forma generală y = mx + b, cunoscută și sub denumirea de formula de interceptare a pantelor. În această ecuație, m este panta liniei și b este valoarea lui y la care graficul, o linie dreaptă, traversează axa y. Astfel panta ecuației Hill este pur și simplu n. Acesta se numește coeficientul Hill sau nH. Pentru mioglobină, valoarea sa este 1, deoarece mioglobina nu se leagă cooperant de O2. Totuși, pentru HbA este 2,8. Cu cât este mai mare numărul nH, cu atât cinetica reacției este mai sigmoidă.
Coeficientul Hill este mai ușor de determinat din inspecție decât efectuând calculele necesare, iar o aproximare este de obicei suficientă.