Conţinut
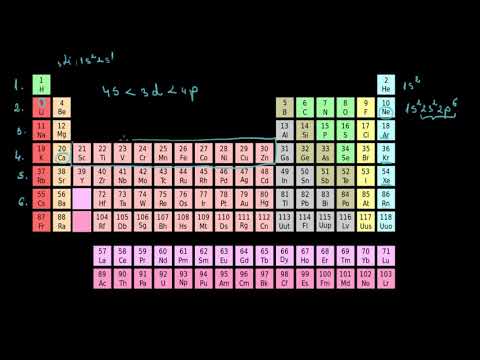
Tabelul periodic este organizat în coloane și rânduri. Numărul protonilor din nucleu crește la citirea tabelului periodic de la dreapta la stânga. Fiecare rând reprezintă un nivel de energie. Elementele din fiecare coloană au proprietăți similare și același număr de electroni de valență. Electronii de valență sunt numărul de electroni aflați în nivelul de energie extern.
Numărul de electroni
••• Tomasz Wyszoamirski / iStock / Getty ImagesNumărul de electroni din fiecare nivel de energie este afișat pe tabelul periodic. Numărul de elemente din fiecare rând arată câți electroni necesită pentru a umple fiecare nivel. Hidrogenul și heliul se află în primul rând sau perioadă, pe tabelul periodic. Prin urmare, primul nivel de energie poate avea un număr de doi electroni. Al doilea nivel de energie poate avea opt electroni. Al treilea nivel de energie poate avea un total de 18 electroni. Al patrulea nivel de energie poate avea 32 de electroni. Conform principiului Aufbau, electronii vor umple mai întâi cele mai scăzute niveluri de energie și vor construi în niveluri superioare numai dacă nivelul de energie înainte de a fi plin.
orbitali


Fiecare nivel de energie este format din zone cunoscute sub numele de orbital. Un orbital este o zonă de probabilitate în care se pot găsi electroni. Fiecare nivel de energie, cu excepția primului, are mai mult de un orbital. Fiecare orbital are o formă specifică. Această formă este determinată de energia pe care o au electronii din orbital. Electronii se pot deplasa oriunde în forma orbitalului la întâmplare. Caracteristicile fiecărui element sunt determinate de electronii din orbital.
Orbitalul S
••• Archeophoto / iStock / Getty ImagesOrbitalul s are formă de sferă. Orbitalul s este întotdeauna primul care se umple la fiecare nivel de energie. Primele două coloane ale tabelului periodic sunt cunoscute sub numele de s-bloc. Aceasta înseamnă că electronii de valență pentru aceste două coloane există într-un orbital s. Primul nivel de energie conține doar un orbital s. De exemplu, hidrogenul are un electron în orbitalul s. Heliul are doi electroni în orbitalul s, umplând nivelul de energie. Deoarece nivelul de energie al heliului este umplut cu doi electroni, atomul este stabil și nu reacționează.
Orbitalul P
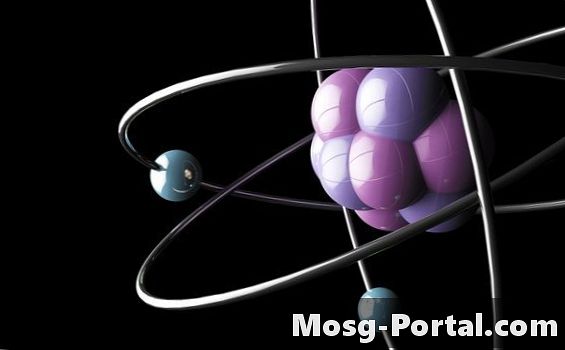
P-orbitalul începe să se umple odată ce s-a umplut s-orbitalul în fiecare nivel de energie. Există trei orbitali p per nivel de energie, fiecare având forma unei lame de elice. Fiecare orbital p conține doi electroni, pentru un număr total de șase electroni în orbitalele p. Conform regulii lui Hund, fiecare orbital p per nivel de energie trebuie să primească un electron înainte de a câștiga un al doilea electron. Blocul p începe cu coloana care conține bor și se termină cu coloana de gaze nobile.
Orbitalii D și F

Orbitalele d și f sunt foarte complexe. Există cinci orbitale d pe nivel de energie, începând cu al treilea nivel de energie. Metalele de tranziție alcătuiesc orbitalele d. Există șapte orbitali f per nivel de energie începând cu al cincilea nivel de energie. Lantanida și actinida formează orbitalele f.