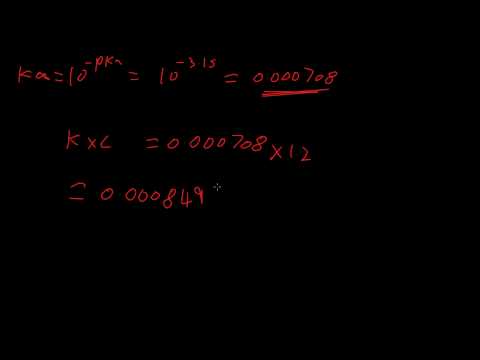
Conţinut
Puterea unui acid este măsurată atât de pH-ul său, cât și de pKa, iar cele două sunt legate de ecuația Henderson-Hasslebalch. Această ecuație este: pH = pKa + log /, unde este concentrația acidului și este concentrația bazei sale conjugate după disociere. pH-ul este o variabilă care depinde de concentrare, așa că, dacă doriți să-i deduceți valoarea din această relație, trebuie să cunoașteți concentrațiile acidului și baza conjugată a acestuia.
Ce sunt pH-ul și pKa?
PH-ul acronimului reprezintă „puterea hidrogenului” și o măsură a concentrației ionilor de hidrogen într-o soluție apoasă. Ecuația următoare exprimă această relație:
pH = -log
Pe de altă parte, valoarea pKa depinde de concentrațiile de acid și baza conjugată în soluție, după ce disocierea acidă a atins echilibrul. Raportul dintre concentrațiile de bază conjugată și acidul conjugat cu acidul în cauză, într-o soluție apoasă, se numește constanta de disociere, Ka. Valoarea pentru pKa este dată de:
pKa = -log (Ka)
Deși pH-ul variază în funcție de soluție, pKa este o constantă pentru fiecare acid.
Ecuația Henderson-Hasselbalch
Formula Henderson-Hasselbalch provine direct din definiția constantei de disociere Ka. Pentru un acid HA care se disociază în H+ și A- în apă, constanta de disociere este dată de:
Ka = /
Putem lua logaritmul ambelor părți:
log (Ka) = log (/), sau jurnal Ka = log (H +) + log /
Referindu-ne la definițiile pH și pKa, aceasta devine:
-pKa = -pH + jurnal /
În cele din urmă, după adăugarea de pH și pKa pe ambele părți:
pH = pKa + log /.
Această ecuație vă permite să calculați pH-ul dacă sunt cunoscute constanta de disociere, pKa și concentrațiile bazei acide și conjugate.