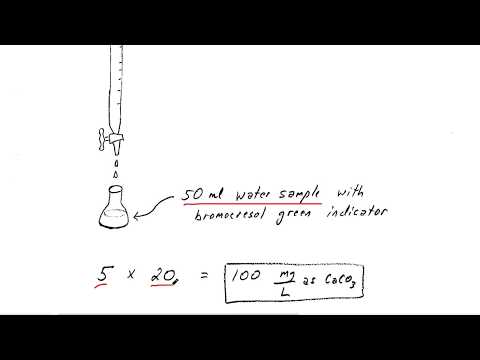
Conţinut
Alcalinitatea este capacitatea unei soluții de a neutraliza un acid până la punctul de echivalență al carbonatului de calciu. Nu trebuie confundat cu elementul de bază. Într-un cadru academic, alcalinitatea este măsurată în miliequivalență pe litru, iar în aplicații comerciale este dată în părți pe milion. Alcalinitatea este adesea măsurată în apa de mare și apă potabilă și poate fi calculată ca suma concentrațiilor de ioni + 2x + -. Pentru a finaliza acest calcul, va trebui să efectuați o titrare pe eșantionul dvs., din care puteți obține alcalinitatea eșantionului.
Măsurați volumul probei de apă în litri. Adăugați o soluție indicator care își va schimba culoarea odată ce soluția a fost complet neutralizată.
Se adaugă acid clorhidric, picătură cu picătură, până când soluția indicatorului își schimbă culoarea. Înregistrați câte picături este nevoie. Convertiți acest număr în litri împărțindu-l la 20.000.
Convertiți cantitatea de acid adăugată în alunițe. Deoarece acidul are o greutate de 5 M, înmulțiți volumul de acid cu 5.
Găsiți echivalentul molar al ionului de hidrogen în acidul dvs. și multiplicați-l cu numărul de aluniți în cantitatea de acid adăugată. Deoarece acidul clorhidric are un echivalent molar de 1, puteți pur și simplu să schimbați unitățile de la alunițe în echivalente.
Determinați molaritatea hidroxidului din proba dvs. Acest lucru se realizează prin împărțirea echivalentului calculat în pasul anterior la volumul probei de apă.
Luați baza de jurnal negativ 10 a molarității hidroxidului pentru a obține alcalinitatea totală a eșantionului. De exemplu, într-un eșantion de 100 ml de apă care a luat 50 de picături de acid clorhidric pentru a neutraliza, împărțiți 50 cu 20.000, pentru a obține 0.0025 L, înmulțiți 0.0025 cu 5 pentru a obține 0.0125 moli, convertiți-l în 0.0125 echivalenți, împărțind 0.0125 la 0.1L pentru a obține 0,125, apoi luând baza de jurnal negativ 10 de 0,125 pentru a obține o alcalinitate totală de 0,903 echivalenți pe litru.