Conţinut
Particulele subatomice sunt protonii, neutronii și electronii individuali care alcătuiesc compoziția atomilor. Cu ajutorul tabelului periodic al elementelor, putem calcula câte particule subatomice există într-un atom dat. Protonii și neutronii se găsesc în nucleul unui atom în timp ce electronii înconjoară nucleul. Masa atomică sau numărul de masă este de obicei dat ca o zecimală, datorită numărului de izotopi găsiți și abundenței relative. Unii izotopi cunoscuți au un număr specific de neutroni și sunt de ajutor atunci când vorbim despre materiale radioactive.
Calcule de bază subatomice
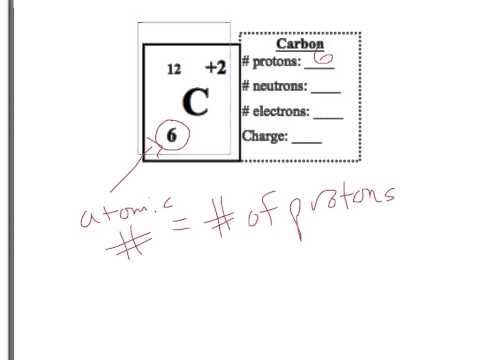
Localizați numărul atomic al unui element dat pe tabelul periodic; acesta este numărul de protoni găsiți în nucleu. De obicei este listat deasupra simbolului elementului. Identitatea unui element se bazează pe numărul de protoni găsiți în nucleu.
Determinați numărul de electroni folosind numărul atomic. Un atom are o sarcină neutră, deci încărcările pozitive și negative sunt egale între ele. Numărul atomic este și numărul electronilor.
Calculați numărul de neutroni luând numărul de masă și scăzând numărul de protoni găsiți în nucleu. Numărul de masă este de obicei situat sub simbolul elementului și reprezintă cât de mult ar cântări un element în grame, dat fiind o molă a substanței. Deoarece masa este centralizată în nucleu, numai protonii și neutronii contribuie la numărul de masă.
Calcule izotopice
Localizați numărul atomic pentru numărul de protoni și electroni din atom pe tabelul periodic. Numărul de protoni și electroni este egal cu numărul atomic.
Calculați numărul de neutroni scăzând numărul atomic din numărul izotopilor. De exemplu, Carbonul 14 are o masă izotopică de 14 și 6 protoni, deci numărul de neutroni este egal cu 8.
Izotopii sunt elemente care diferă în masă. Deoarece masa este derivată din nucleu și protonii dau identitatea unui element, numărul de neutroni diferă în izotopi.