Conţinut
- TL; DR (Prea lung; nu a citit)
- Înțeles Dilution
- Înțeles pH
- Diluarea unui acid
- Diluarea unui Alkali
- Calcularea efectului de diluare a pH-ului
Diluarea este o tehnică de laborator comună pe care o întâlnesc majoritatea studenților de știință atunci când doresc să obțină o concentrare specifică a unei soluții. Dar este și ceea ce faci când adaugi apă la mâncare și băuturi acasă pentru a le face mai mult pe placul tău. Diluarea afectează multe proprietăți ale unei soluții, inclusiv nivelul pH-ului.
TL; DR (Prea lung; nu a citit)
Diluarea face ca o soluție acidă să fie mai alcalină, iar o soluție alcalină mai acidă. Pentru a determina efectul de diluare al pH-ului, determinați concentrația ionilor de hidrogen și transformați-o în pH folosind o formulă simplă de lucru.
Înțeles Dilution
Pentru a dilua o soluție apoasă, adăugați pur și simplu apă. Aceasta crește proporția de solvent sau materialul lichid pentru diluare în comparație cu cea a solutului sau a componentei dizolvate în solvent. De exemplu, dacă diluați apa sărată, soluția va conține aceeași cantitate de sare, dar cantitatea de apă va crește.
Înțeles pH
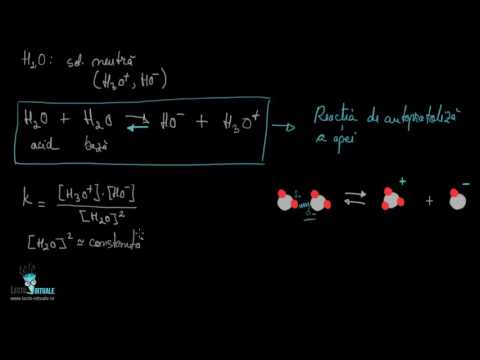
Scala pH-ului măsoară cât de substanță este acidă sau alcalină. De la 0 la 14, pH-ul 7 fiind neutru, un pH mai mic decât 7 fiind acid și un pH mai mare decât 7 fiind alcalin. Scala este logaritmică, ceea ce înseamnă că fiecare valoare a pH-ului întreg sub 7 este de zece ori mai acidă decât următoarea valoare mai mare. De exemplu, pH 3 este de zece ori mai acid decât pH 4 și de 100 de ori mai acid decât pH 5.
Același lucru este valabil și pentru valorile de pH peste 7. Fiecare valoare este de zece ori mai mult alcalină decât următoarea valoare totală inferioară. De exemplu, pH 9 este de zece ori mai mult alcalin decât pH 8 și de 100 de ori mai alcalin decât pH 7. Apa pură sau distilată are un pH de 7, dar când adăugați substanțe chimice în apă, soluția poate deveni acidă sau alcalină. Nivelul de pH al unei soluții este o măsură a concentrației sale ionice de hidrogen. Soluțiile cu o concentrație mare de ioni de hidrogen au un pH scăzut, iar soluțiile cu concentrații mici de ioni H + au un pH ridicat.
Diluarea unui acid
Substanțele acide includ cafeaua neagră, acidul bateriei și sucul de lămâie. Diluarea unui acid scade concentrația ionilor H + (aq), ceea ce crește nivelul de pH al soluției spre 7, ceea ce îl face mai puțin acid. Cu toate acestea, nivelul de pH al unei soluții acide nu poate deveni mai mare de 7, deoarece apa pe care o adăugați pentru a o dilua nu este alcalină.
Diluarea unui Alkali
Substanțele alcaline includ amoniacul, praful de copt și înălbitorul. Diluarea unui alcalin scade concentrația de ioni OH- (aq), ceea ce scade nivelul de pH al soluției spre 7, ceea ce îl face mai puțin alcalin. Cu toate acestea, nivelul de pH al unei soluții alcaline nu poate deveni mai mic decât 7, deoarece apa pe care o adăugați pentru a o dilua nu este acidă.
Calcularea efectului de diluare a pH-ului
Nivelul de pH al unei soluții este o măsură a concentrației sale ionice de hidrogen. Soluțiile cu o concentrație mare de ioni de hidrogen au un pH scăzut, iar soluțiile cu concentrații mici de ioni H + au un pH ridicat. O definiție simplă de lucru a pH-ului este pH = - log, unde este molaritatea ionului de hidrogen. Un logaritm al unui număr este pur și simplu exponentul atunci când scrii acel număr ca o putere de zece. Definiția pH-ului rezolvat pentru molaritatea ionului de hidrogen este atunci = 10-pH. De exemplu, molaritatea ionilor de hidrogen într-o soluție de pH 6 este 10-6 M. Folosiți acest calcul pentru a estima concentrația ionilor de hidrogen înainte de diluare.
După diluare, măsurați volumul soluțiilor noi. De exemplu, dacă diluați soluția de patru ori volumul inițial, concentrația va fi redusă la un sfert. Dacă volumul inițial este V1, iar volumul total după diluare este V4, concentrația finală va fi V1 / V4 de concentrația inițială. Puteți converti apoi concentrația ionilor de hidrogen în pH folosind pH = - log.