O constantă de rețea descrie distanța dintre celulele unitare adiacente într-o structură cristalină. Celulele unitare sau blocurile de construcție ale cristalului sunt tridimensionale și au trei constante liniare care descriu dimensiunile celulei. Dimensiunile celulei unității sunt determinate de numărul de atomi ambalați în fiecare celulă și de modul în care sunt aranjați atomii. Este adoptat un model cu sfere dure, care vă permite să vizualizați atomii din celule ca sfere solide. Pentru sistemele cu cristale cubice, toți cei trei parametri liniari sunt identici, astfel încât o constantă dintr-o singură rețea este utilizată pentru a descrie o celulă cubică.
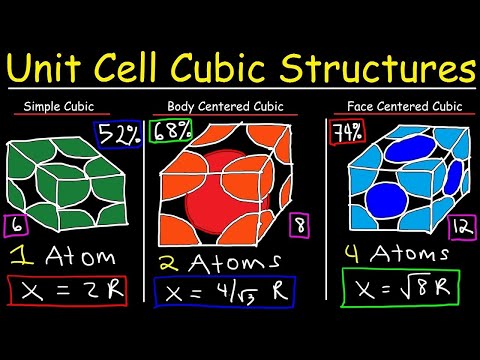
Identificați zăcământul spațial al sistemului cu cristale cubice pe baza dispunerii atomilor din celula unității. Grosimea spațială poate fi simplă cubică (SC), cu atomi poziționați doar la colțurile celulei unității cubice, cubică centrată pe față (FCC) cu atomi, de asemenea, centrați în fiecare față a celulei unității sau cubică centrată pe corp (BCC) cu un atom inclus în centrul celulei unității cubice. De exemplu, cupru cristalizează într-o structură FCC, în timp ce fierul cristalizează într-o structură BCC. Poloniul este un exemplu de metal care cristalizează într-o structură SC.
Găsiți raza atomică (r) a atomilor în celula unității. Un tabel periodic este o sursă adecvată pentru razele atomice. De exemplu, raza atomică a poloniului este de 0,167 nm. Raza atomică a cuprului este de 0,128 nm, în timp ce cea a fierului este de 0,124 nm.
Calculați constanta de rețea, a, a celulei unității cubice. Dacă zăbreala spațială este SC, constanta de rețea este dată de formula a =. De exemplu, constanta de rețea a poloniului cristalizat SC este sau 0,334 nm. Dacă zăbreala spațială este FCC, constanta de rețea este dată de formulă și dacă zăbreala spațială este BCC, atunci constanta de rețea este dată de formula a =.