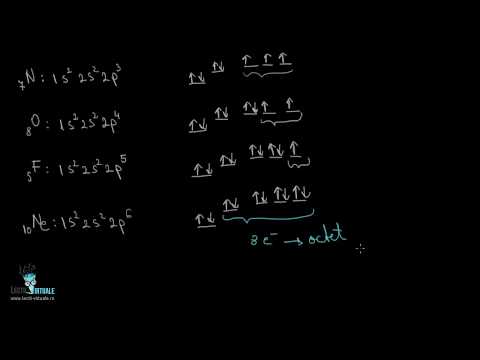
Conţinut
Un atom este format dintr-un nucleu care conține particule încărcate pozitiv înconjurat de un nor de electroni încărcați negativ. Electronii din atomi se așază într-o serie de „cochilii” din jurul nucleului și fiecare înveliș poate conține un număr fix de electroni. Se spune că elementele care au o carcasă exterioară completă au o configurație electronică stabilă. Elementele cu configurații stabile de electroni apar numai într-o singură coloană (grupul 8) din tabelul periodic. Prin urmare, marea majoritate a elementelor din tabelul periodic au configurații electronice instabile.
Hidrogen
Hidrogenul este cel mai simplu element din tabelul periodic și constă dintr-un singur proton și un singur electron. Singurul electron este situat în coaja 1s, care poate avea doi electroni. Prin urmare, configurația electronică a hidrogenului nu este stabilă. Pentru a umple coaja 1s, doi atomi de hidrogen se combină și împărtășesc cel de-al doilea electron. Aceasta este cunoscută sub numele de legătură covalentă și, în acest caz, duce la formarea unei molecule de hidrogen.
Sodiu
Sodiul este în grupa 1 a tabelului periodic și fiecare atom include 11 electroni. Un singur electron este situat în carcasa exterioară a 3s, care este capabilă să dețină 2 electroni. Deoarece aceasta este o configurație instabilă a electronilor, sodiul își pierde adesea electronul 3s extern, producând un ion încărcat pozitiv. Ionii încărcați pozitiv și negativ se combină pentru a forma molecule. Aceasta este cunoscută sub numele de legătură ionică și în sodiu duce la o varietate de molecule, inclusiv clorura de sodiu.
Carbon
Carbonul se află în grupa 6 a tabelului periodic și posedă în total șase electroni. Carcasa electronică exterioară de 2p este ocupată de doi electroni. Deoarece cochilii de 2p pot conține șase electroni, carbonul nu se află într-o configurație de electroni stabilă. Pentru ca carbonul să obțină o configurație de electroni stabilă, trebuie să partajeze alți patru electroni prin legături covalente. Acest proces duce la o cantitate mare de compuși de carbon, cum ar fi metanul.
Clor
Clorul se află în grupa 7 a tabelului periodic și posedă 17 electroni. Învelișul exterior 3p este ocupat de cinci electroni și, prin urmare, necesită încă un electron pentru a avea o configurație stabilă. Clorul câștigă adesea acest electron suplimentar în detrimentul de a deveni un ion încărcat negativ. Aceasta înseamnă că clorul se poate combina cu orice ion încărcat pozitiv, formând o legătură ionică. Un bun exemplu este clorura de sodiu, care este cunoscută și sub denumirea de sare de masă.